









Estudo dos Gases
Diagrama de Estado:
Denomina-se diagrama de estado o gráfico da pressão em função da temperatura de uma determinada substância.
Temos dois casos:
Observe que, conforme a pressão e a temperatura da substância, ela pode se apresentar nos estados: sólido, líquido ou gasoso.
Um ponto da curva de fusão representa as condições de existência dos estados sólido e líquido; da mesma forma, um ponto da curva de vaporização representa as condições de coexistência dos estados líquido e gasoso.
O ponto T chamado ponto triplo representa as condições de temperatura e pressão para as quais os estados sólidos, líquido e gasoso coexistem em equilíbrio.
Os gráficos mostram que podemos variar o estado físico de uma substância através de variações de pressão, de temperatura ou ambos.
Suponha por exemplo, uma substância no estado A(p A , t A ) da figura.
Essa substância, inicialmente no estado sólido, poderá passar ao estado líquido das seguintes maneiras:
• diminuindo-se a pressão (p A ® p B ), mantendo-se a temperatura constante (t A );
• aumentando-se a temperatura (t A ® t C ) e mantendo-se a pressão (p A );
• aumentando-se a temperatura (t A ® t D ) e diminuindo-se a pressão (p A ® p D ).
- Gás e Vapor:
A partir de uma determinada temperatura, característica de cada substância, denominada temperatura crítica (t C ), não pode mais ocorrer a vaporização e a condensação.
Isto é, para uma temperatura maior que a temperatura crítica, a substância encontra-se sempre no estado gasoso, qualquer que seja o valor da pressão.
Através da temperatura crítica podemos estabelecer a diferença entre gás e vapor.
Gás : é a substância que, na fase gasosa, se encontra em temperatura superior à sua temperatura crítica e que não pode ser liquefeita por compressão isotérmica.
Vapor : é a substância que, na fase gasosa, se encontra em temperatura abaixo de sua temperatura crítica e que pode ser liquefeita por compressão isotérmica.
- Estudo dos Gases
Os gases são constituídos de pequenas partículas denominadas moléculas que se movimentam desordenadamente em todas as direções e sentidos.
O estado de um gás é caracterizado pelo valor de três grandezas físicas: o volume V, a pressão p e a temperatura T, que são denominadas variáveis de estado de um gás.
O volume de um gás é devida aos choque das suas moléculas contra as paredes do recipiente, e a sua temperatura mede o grau de agitação de suas moléculas.
Em geral, a variação de uma dessas variáveis de estado provoca alteração em pelo menos uma das outras variáveis, apresentando o gás uma transformação e conseqüentemente um estado diferente do inicial.
As transformações mais conhecidas são:
Isotérmica
Ocorre à temperatura constante
Isobárica
Ocorre sob pressão constante.
Transformação
Isométrica ou Isocórica
Ocorre a volume constante.
Adiabática
Ocorre sem troca de calor com o meio externo.
OBS.: A pressão 1 atm e a temperatura 273K ou 0ºC caracterizam as condições normais de pressão e temperatura que indicamos CNPT.
- Leis das Transformações dos Gases:
a) Lei de Boyle - Mariotte: Suponha que uma determinada massa gasosa contida em um recipiente de volume V é submetida à pressão p. Como já foi visto, esta pressão p é devido aos choques das moléculas do gás contra as paredes do recipiente. Se diminuirmos o volume V, a freqüência de choques aumenta e, portanto, a pressão também aumenta.
Se durante o processo mantivermos a temperatura T constante, pode-se verificar que a pressão varia de uma forma inversamente proporcional ao volume. Esta conclusão representa a lei de Boyle-Mariotte e pode ser enunciada da seguinte forma:
Em uma transformação isotérmica, a pressão de uma dada massa de gás é inversamente proporcional ao volume ocupado pelo gás.
PV = constante
Esta constante depende da massa e da natureza do gás, da pressão e das unidades usadas.
A representação gráfica da pressão em função do volume é uma hipérbole equilátera chamada Isoterma.
Com o aumento da temperatura, o produto P.V torna-se maior e as isotermas se agastam da origem dos eixos.
- Lei de Gay: - Lussac: Suponha que uma determinada massa gasosa está contida em um cilindro provido de um êmbolo móvel, sujeito a uma pressão constante p exercida pela atmosfera.
Com o aquecimento do sistema, as moléculas do gás se agitam mais rapidamente, aumentando o número de choque contra as paredes do recipiente, deslocando o êmbolo móvel para cima até que haja um equilíbrio entre a pressão interna e a externa.
Desta maneira, à medida que aumentamos a temperatura do gás, ocorre aumento do volume por ele ocupado no cilindro, enquanto a pressão permanece constante.
Esta conclusão representa a lei de Gay-Lussac enunciada da seguinte forma:
Em uma transformação isobárica, o volume ocupado por uma dada massa gasosa é diretamente proporcional à temperatura.
= constante Nessa fórmula a temperatura deve ser dada em Kelvin
A representação gráfica de uma transformação isobárica é uma reta.
• Lei de Charles: Esta lei diz respeito às transformações isocóricas ou isométricas, isto é, aquelas que se processam a volume constante, cujo enunciado é o seguinte:
O volume constante, a pressão de uma determinada massa de gás é diretamente proporcional à sua temperatura absoluta, ou seja:
= constante
Desta maneira, aumentando a temperatura de um gás a volume constante, aumenta a pressão que ele exerce, e diminuindo a temperatura, a pressão também diminui. Teoricamente, ao cessar a agitação térmica das moléculas a pressão é nula, e atinge-se o zero absoluto.
A representação gráfica da transformação isométrica é uma reta:
Equação Geral dos Gases Perfeitos:
Quando as três variáveis de estado de uma determinada massa de gás, pressão volume e temperatura, apresentarem variações, utiliza-se a equação geral dos gases que engloba todas as transformações vistas anteriormente.
A representação gráfica desta transformação pode ser mostrada em um gráfico de dois eixos cartesianos, considerando-se um feixe de isotermas, cada uma delas correspondendo a uma temperatura.
OBS.: Para o estudo dos gases criou-se um modelo teórico, chamado gás perfeito ou ideal, com as seguintes características:
- O movimento das moléculas é caótico, isto é, não existem direções privilegiadas. Seu movimento é regido pelos princípios da Mecânica Newtoniana.
- Os choques entre as moléculas e as paredes e entre as próprias moléculas são perfeitamente elásticos.
- Não existem forças de atração entre as moléculas, e a força gravitacional sobre elas é desprezível.
- O diâmetro da molécula é desprezível em comparação com a distância média que percorre entre as colisões.
- Equação de Clapeyron:
A equação de Clapeyron relaciona as variáveis da pressão, do volume e da temperatura, incluindo também a massa m da substância gasosa como variável, durante uma transformação.
Para se chegar à sua expressão analítica, é necessário relembrar os seguintes conceitos:
- O mol de qualquer gás contém o mesmo número de moléculas, chamado número de Avogadro (N = 6,023 . 10 23 moléculas)
- Moléculas-grama (M) é a massa em gramas de um mol, isto é, a massa em gramas de 6,023 . 10 23 moléculas.
- Volume molar é o volume ocupado por um mol de gás, independendo da natureza desse gás. Nas condições normais de pressão e temperatura, o volume de um mol de um gás perfeito vale 22,4 litros .
- O volume V 0 de um gás pode ser expresso pelo produto do número de moléculas-grama pelo, ou seja: V 0 = nv 0 onde n = nº de moléculas grama do gás. V 0 = volume do mol
- O número de mols de uma determinada massa m de um gás pode ser pode ser expresso por: n = m/M , onde n = número de mols
M = massa da molécula-grama
m = massa do gás
Consideremos a transformação de uma massa m de gás, de um estado qualquer (p, V, T) para estado definido pelas condições normais de pressão e temperatura (p 0 , V 0 , T 0 ).
Aplicando a equação geral dos gases perfeitos, vem:
As grandezas p 0 , V 0 e T 0 são constantes, pois referem-se às condições normais de pressão e temperatura. Logo, a expressão também é uma constante.
Fazendo-se R = , vem = nR ou pV = nRT Equação de Clapeyron
Como p 0 = 1,0atm; v 0 = 22,4 e T 0 = 273K, o valor de R é:
Constante universal dos gases perfeitos
O valor de R é o mesmo para todos os gases, dependendo apenas das unidades a serem utilizadas.
- Lei de Dalton
A Lei de Dalton refere-se às pressões parciais dos vários gases componentes de uma mistura gasosa.
Consideremos uma mistura gasosa contida em um recipiente rígido de volume V. Seja p a pressão exercida pela mistura.
Se por um processo qualquer deixamos no recipiente apenas as partículas de um dos gases componentes da mistura, retirando todas as outras, o gás que permaneceu ocupará sozinho todo o volume V do recipiente (propriedade dos gases) e exercerá uma pressão p 1 menor que p.
A esta pressão denominamos pressão parcial do gás 1 na mistura gasosa.
Pressão parcial de um gás é a pressão que este exerceria se ocupasse sozinho, a mesma temperatura, todo o volume da mistura gasosa a qual pertence.
Dalton chegou à conclusão que a soma das pressões parciais dos gases componentes de uma mistura gasosa é igual à pressão total exercida pela mistura, desde que os gases não reajam entre si.
P total = p 1 + p 2 + p 3 + ... + p n
Cálculo da Pressão Total: Num mesmo recipiente, misturamos os gases 1 , 2 e 3 em diferentes condições, conforme indica a figura:
Determinemos a pressão total p da mistura gasosa, admitindo que os gases não reajam entre si.
O número de mols total da mistura é: n = n 1 + n 2 + n 3 1
Pela equação de Clapeyron, temos
p1V1 = n1RT1 ® n1 = Substituindo-se em 1 , vem:
p2V2 = n2RT2 ® n2 = =+ +
p3V3 = n3RT3 ® n3 =
pV = nRT ® n =
- Teoria Cinética do Gás Perfeito:
• Introdução: A teoria cinética do gás perfeito foi desenvolvida a partir da aplicação das leis da Mecânica de Newton a sistemas microscópicos dos gases, ou seja, às suas partículas.
• Hipóteses: Algumas hipóteses forma atribuídas ao comportamento das moléculas de um gás perfeito:
- Todas as moléculas são idênticas, tendo a forma de “esferas rígidas”
- Todas as moléculas estão em movimento desordenado, em todas as direções.
- Os choques entre as moléculas e contra as paredes do recipiente são perfeitamente elásticos.
- Entre os choques as moléculas se movem em MRU.
- As moléculas não exercem forças de ação mútua entre si, exceto durante os choques.
- As moléculas têm dimensões desprezíveis em comparação com os espaços vazios que as separam.
• Pressão de um gás: As moléculas de um gás estão em constante e desordenados movimento, chocando-se com as paredes do recipiente, causando o aparecimento de uma força F, que age contra as paredes.
A relação entre a força f e a área A da parede corresponde à pressão p que o gás exerce sobre o recipiente (p = F/A).
onde: m = massa do gás.
V = volume da massa do gás.
v = velocidade média das moléculas do gás






 ) a partir da capacidade térmica de um corpo composto por ela (
) a partir da capacidade térmica de um corpo composto por ela (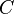 ) e da
) e da 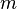 ).
).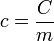
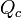 ), da variação térmica que ele sofre (
), da variação térmica que ele sofre ( ), e da massa desse corpo.
), e da massa desse corpo.





